2025届重庆市第一中学校高三下学期2月开学考试,高中\高三\重庆市\2024-2025学年下\化学三零论坛(30论坛)用百度云盘、腾讯云盘分享的原卷版、解析版及答案,在云盘中的课件资料可在线阅读及保存到自己的云盘,此电子版课件永久免费阅读及下载。

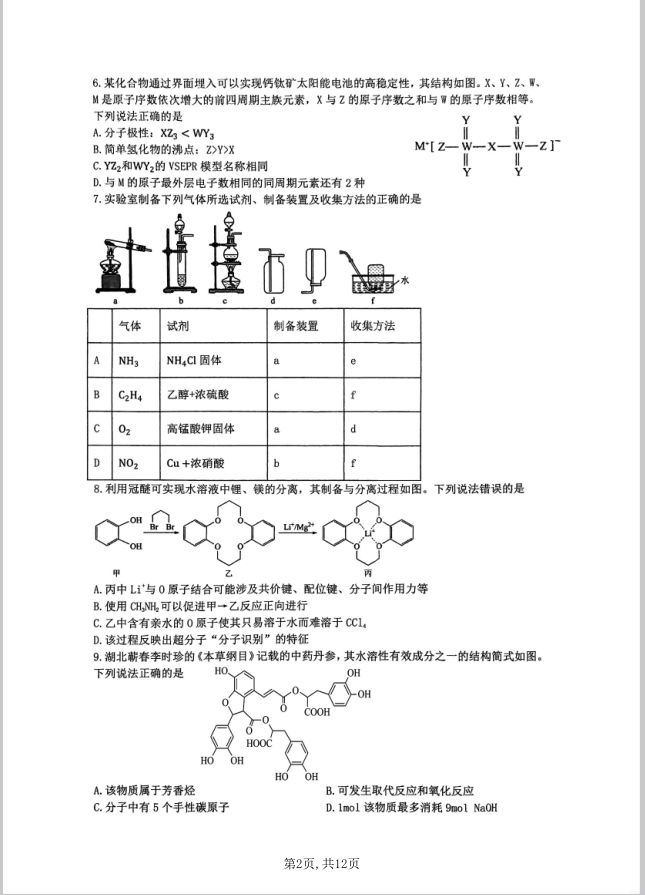
一、 选择题 1. A项,烟花属于一种发射光谱:B项,古代铜钱应为合金:C项, 芯片的主要成分是单晶硅。 2.D项,还原性:I>Fe”,C1,先氧化I「,后氧化Fe”,C2通入Fel2溶液中至Fe2+恰好完全反 应,T也被完全氧化,离子方程式为3Cl2+2Fe2++4I=6CI-+2Fe3++22,故D错误 3.B项,F0中心原子N原子价层电子对数为2-11-123,空间构型为V形:C项,CsF 为离子化合物,电子式为 a 4.B项中无电子对的得失。 5.B项,石墨是混合品体,P90。 6.X、Y、Z、m、M分别为N元素、0元素、F元素、S元素、K元素。A项,XZ为NF3,NF3 的中心原子N的价层电子对数为4,孤电子对数为1,空间结构为三角锥形,属于极性分子, WY3为S03,S03空何结构为平面三角形,属于非极性分子,故极性:XZ3>WY3:B项,常 温下Hz0为液态,F和NH3为气态,所以水的沸点最高,即Y的简单氢化物沸点最高:D项, K原子最外层电子数为1,与其同周期且最外层电子数相同的元素还有Cr、Cu两种。 7. B项,浓硫酸作用下乙醇在170℃条件下发生消去反应生成乙烯和 水,则题给装置缺少温度计无法制得乙烯:D项,铜与浓硝酸反应生成硝酸铜、二氧化氮和 水,二氧化氮能与水反应生成硝酸和一氧化氮,不能用排水法收集。 8. A项,超分子通过非共价键作用力形成,包括氢键、静电作用力、 琉水作用等。而C该冠醚结构既有亲水的氧原子又有亲油的亚基等,因此冠醚具有普遍的可 溶性。常用作相转移的催化剂。 9. C将连有四个不同基团的碳原子称为手性碳原子,该有机结构中, HO OH COOH HO OH 一共有4个手性碳:D项,该物质中含有7个酚羟基,2 个羧基,2个酯基,则1mol该物质最多消耗11 mol Na0州。 10.A项,CH3C00H是弱酸,电离需要吸热,1mo1CH3C00H的溶液与含1mo1MaOH的稀溶 液混合,放出热量小于57.3kJ,A错误:B项,甲烷的燃烧热△H=-890.3k/mol,生成液态 水放出热量为890.3kJ,则生成气态水放热少,CH,(g)+202(g)=C02(g)+2H20(g) △H>-890.3k/mol,:C项,合成氨反应为可逆反应,1.5molH2和过量的N2在此条件下充 分反应,放出热量小于46.2kJ,C错误 11.B项,在原电池内电路中阳离子向正极移动,若隔膜为阳离子膜,电极溶解生成的铜离 子要向右侧移动,通入氨气要消耗铜离子,显然左侧阳离子不断减小,明显不利于电池反应 正常进行:C项,由分析可知,左侧负极是Cu-2e+4NH3=[Cu(NH3),]2+,正极铜极上 钥离子得到电子发生还原反应生成铜:Cu2++2e=Cu,则电池总反应为:Cu2++4NH3= [Cu(NHg)4]2+:D项,NH3扩散到乙室会与铜离子反应生成[Cu(NHg)4]+,铜离子浓度降低, 钥离子得电子能力减弱,因此将对电池电动势产生影响。 12.A项,由品胞结构可知,品胞中N点所在的正八面体的体心为原点坐标,硼硼键的键长 为dm,N点到原点的距离为号dn:品胞参数为an,钙原子的坐标参数为(),则N 点在x轴的坐标为 是二-受所以N点的坐标参数为(尝00 anm 13.B项,a、c对比,c处c()大于a处的,cH)越高越抑制水的电离,所以a处水的电离 程度大于c处水的电离程度:b点时,氢氧化钠与HM恰好完全反应,此时溶液中仅为NA, 已知HA为弱酸,则NA中A水解会促进水的电离,即b处水的电离程度大于a,综合看, 水的电离程度:b>a>c,B错误:C项,d点时,c(H)=l0ol/L,c(0H)=10mol/L,NaA在 水中存在如下水解A+H20=HA+OH,则K=:O口=≤,即织=On= c(4-) C(HA) Kw 00=10524,故1g品=5.24,C正确:D项由B分析可知,b点时溶液仅为, 104X10476 由于A存在部分水解,其在水中以A和HA两种形式存在,根据物料守恒,可知 c(Na)=c(A)+c(HA),D错误。 14. D项,T下,甲醇的转化率为60%, CH3OH(g)+CO(g)=CH3COOH() n始0.20 0.22 n消0.12 0.12 n平0.08 0.10 达到平衡,此时容器的体积为2L,c(C,0)=0.04mol·L,c(C0)=0.05mol·L',化学平衡 常数仁 c(CH00-c(C0)0.04×0.05 L=500,再充入0.12mo1CH,0州和0.06mo1C0,此时气体总物质的 量与原平衡时气体总物质的量相等,即容器的体积为4L,时 (CH.OH)0.0mC.m 4L 1一K,说明平衡不移动,D说法正确。 0.05x0.04 15.(14分,每空2分) (1)sp除去炭黑和有机粘合剂 (2)A1,0+2Na0H=2NaA10,+H,0 (3)将Co还原为Co (4)12<p(C,0)s13 (5)2Mn2+5S,0+8H,0-2MnO,+10S0}+16H (6)①C(1分) ②品体(1分) 16.(共14分) (1)4NaH+B(OCH,), 240℃ NaBH,+3CH,ONa(2分) (2)C(2分) (3)圆底烧瓶(2分) (4)节约萃取剂,萃取效率高(萃取剂循环使用的意思)(2分) (5)A(1分) D(1分) (6)63(2分)偏低(2分) (2)A空气具有氧化性,通入氮气排净空气防止Na,NH,NaBH 等被氧化。B空气冷凝管适用于高沸点(大于140℃)液体的蒸馏与回流,以免球形冷凝管 通水冷却导致玻璃温差大而炸裂。CNH和Na均与水产生氢气。D快速滴入B(OCH,),不利 于其提高转化率,但是可以提高反应速度。 (3,4)异丙胺溶液从圆底烧瓶中被蒸馏至索氏提取器内,浸泡滤纸套筒内的固体混合 物,待异丙胺溶液液面超过虹吸管最高点后,通过虹吸现象将H,的异丙胺溶液转移至圆 底烧瓶中,再通过蒸馏,使异丙胺溶液继续进入索氏提取器,实现少量萃取液对固体混合物 的连续萃取。NaB可溶于异丙胺、而CH,ONa难溶于异丙胺,故当萃取完全后,NaBH随异丙 胺进入圆底烧瓶中。循环使用萃取液,节约萃取液的用量。 (5)N阻,在强碱环境下能稳定存在,故X,溶液为氢氧化钠溶液:碘离子和碘酸根离子 在酸性条件下反应:CH,C00H和CHCO0Na混合液中溶质物质的量之比均为1:1,可以认为 e (CH,COOH)=e(CH,COONa) K,(CH,COOH)=- c()e(CHcoo)-c()1x1 c(CH,COOH) 则pH=5,故缓冲溶液为CH,CO0H和CH,C0ONa混合液。 (6)2.00mL碘量瓶内NaBH,与26.00mL,0.1000mol/LKI0溶液充分反应后,剩余的过 量KI0与KI溶液反应生成碘单质,存在I03I,6NaS,O。则剩余的过量KI0的物质的量为 6aL×0.1mol/L。与2.00mL确量瓶内NaB阻,反应的K10的物质的量为20aL×0.1mol/L。故 2.00mL碘量瓶内NaBH的物质的量为15mL×0.1mol/L。则9.00g样品内NaBH(相对质
样本阅读结束,请到下载地址中:阅读全文及下载