2025届福建省漳州市高三下学期第三次教学质量检测,高中\高三\福建省\漳州市\2024-2025学年下\化学三零论坛(30论坛)用百度云盘、腾讯云盘分享的原卷版、解析版及答案,在云盘中的课件资料可在线阅读及保存到自己的云盘,此电子版课件永久免费阅读及下载。

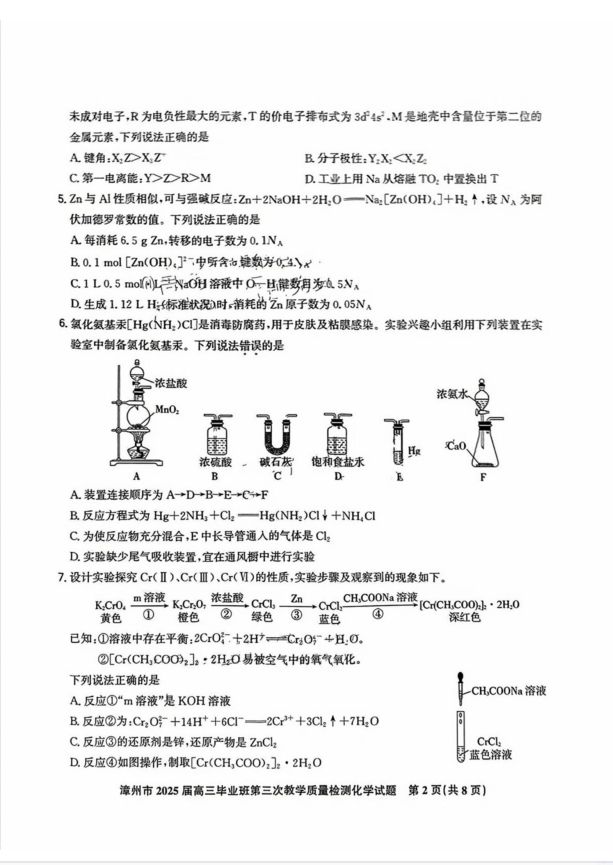
【解题思路】A环已醇(J)中羟基可与HX(X表示卤素 原子)、一C00H等发生取代反应,能在浓魔酸,加热 条件下发生清去反应,能在铜作催化剂条件下与氧气 发生氧化反应:BK,M中没有连接4个不同原子或原 子团的碳原子:CL分子中酮藏基上顾原子为sp杂 化,其余碳原子均为p杂化,所有原子不可能共平 面:D根据质量守恒定律,J+L减少2个H原子, K→M诚少2个AcO一,N的结构简式为AcOH。 【解题思路】A用铜电极电解饱和食盐水,阳极的电极 反应式:Cu一2e一Cu2+,B侯氏制碱法(又称联合 制碱法),即将二氧化碳通入氨化的氯化钠饱和溶液 中,使溶解度小的碳酸氢钠从溶液中析出:D.硫单质 能与热的NOH溶液反应,生成可溶于水的 Na S.Na:SO. 【解题思路】根据题给信息可推断出X,Y、Z、R,T、 M分别为H.C,O、F、Ti,Fe元素,A.HO,HO的 价电子对数均为4,H0离子中有1对孤电子对, HO分子中有2对孤电子对,由于孤电子对间的斥力 大于孤电子对与成键电子对间的斥力,因此键角: HO>H2O:BCaH2是非极性分子,HO2是极性 分子:CC、O、F是同一周期的主族元素,随着核电荷 数的递增,第一电离能呈现增大的趋势:F©是金属元 素,第一电离能小于非金属元素:D.工业上用Na从熔 胜TiCL中置换出Ti 【解题思路】A每消耗0.1 mol Zn,转移0.2mole; H0、 B由 的结构可看出0.1mol H-0 0-H [Zn(OH),]-所含c键数为0.8Na:C.1L 0,5mol·L-1NaOH溶液中NaOH和HO均含有 O一H键,数日大于0.5NA· 【解题思路】A.A+D+B产生干燥纯净的氯气,F+C 产生干燥纯净的氨气,在E中混合发生反应:CNH 密度小,从长导管通人有利于反应物充分混合 【解题思路】A反应①中“m溶液”可以是硫酸溶液,增 加H浓度,反应①平衡正向移动:BC2O片具有强 氧化性,可将C氧化为C:C反应6)的氧化产物是 ZC:D.反应④生成物[Cr(CH COO):]:·2H0易 被空气中的氧气氧化,应该在隔绝空气条件下制备。 B [解题思路】A根据“水浸”后得到NSO4,NMoO, 溶液,可推出“培烧”时,MoS与NCO,O2反应的 化学方程式为2MoS+6Na:C0,+9O: 婷烧 2Na:MoO,十4Na:SO,十6CO2:BNiS,Fe的硫化物会 被O2氧化生成NiO、F©O,“水浸”时,SO2,NiO. F©O,不溶于水,是“水浸”后滤渣的主要成分:C“净 化时,MgSO,与溶液中Na:CO,反应,生成MgCO, 沉淀:D.“水浸“净化”“降退结品”后均要进行周、液 分离,由已知和C选项分析可知,降祖结品主要析出 Na:SO4·10HO. 【解题思路】A.A电极HPbO:(P%+2价)→P% (0价)得电子,为正极:B电极H2失电子,为负极:根 据离子移动方向可判断X为阳离子,向正极移动,结 合图中信息可知为Na:C理论上每消耗0.1olH 反应转移0.2m©l电子,通过交换膜的Na为 0.2mol:从工业应用原理及图示上有泄压阀可知,通 入的H过量,故无法以通人的H2量进行计算:D.由 于H:不易附着在电极上,在电极表面使用催化材料 和气体扩散层可以提高H:在电极上的反应速率和利 用率,进面提升电池效率。 B 【解题思路】由a点pH=1,14可知HAˉ没有完全电 离。室温下,0.1mol·L-KOH溶液滴定10ml 0.05mol·L-1Mg(HA):溶液,反应的先后顺序为: OH+HA一A2+HO、2OH+Mg+ Mg(OHD,t,由图像可知:b点前KOH溶液滴定 HAˉ,从b点到c点KOH溶液滴定Mg+。A由水 解离子方程式:Mg++2H20一Mg(OHD:十2H, 可计算该反应的水解平衡常数,K=S三( e(Mg+) (H)Xe(OH) K超 (10-4)2 e(Mg)Xe(OH)K[Mg(OH)] 10儿客学 10M5,Ba点溶液中离子的电荷守恒表达式为 c(H)+2c(Mg)=c(OH)+2c(A)+ c(HA):Cb点溶液溶质为K:A和MgA,根据物料 守恒cMe)=2c(A)+e(HA)+e(H,A]: D.Mg+和A一均发生水解,b点时,水的电离程度最 大,随着强碱溶液加人,水的电离程度减小。 (17分) (1)3d4s2(1分) (2)2FeS+15Mn02+28H+-2Fe++15Mn2++ 4S0+14H:0(2分)】 (3)①AgC1、ASO,(2分) ②AgSO4(s)+ 2C(aq)一2AgC(s)+S0片(q)(1分), K-cs0)cS0)·c2(Ag) c2(CIT)c2(C)·c2(Ag) Km(Ag:S0)1.2×103 K(AgC)(1.8×10下≈37X10“,该反应 进行比较彻底,沉银效果好(1分)③否(1分) NCO与盐酸反应产生氯气,污染环境(2分) (4)温度低于30℃沉锰速率慢,温度高于30℃, NH HCO,分解,锰沉淀率降低(2分) (5)04(1分)②C(2分)③L85X10 a'cNA (2分) 【解题思路】(3)②硫酸银微溶,氯化银难溶: AgSO,(s)+2CI (aq)-2AgCl(s)+SO (aq), 算可得化学反应平衡常数较大,该反应进行比较彻 底,沉银效果好。(5)②注意沿y轴的方向的视角,可 认为从晶胞后面往前看,以品跑内上方大灰球为例, 从后往前投影的位置应在左侧,所以应选择C项: ③根据均摊法可知1个晶胞中有2个Ag:Hgl, 2M1850 NANA R.V=a'cx10-*cm', 1.85×109 P-V a'cNA g·cm3。 ,(16分) (1)浓硝酸被还原生成有毒气体NO2,污染环境 (1分) (2)①放热(1分)②低温下,活化分子百分数少, 活化分子数目少,反应速率慢(2分) (3)①5HS05+2MnO元+H-5S0片+2Mn2++ 3H0(2分)②环己醇过量.加热(2分) (4)用少量蒸馏水洗涤滤渣2一3次(2分)蒸发 浓缩,冷却结品(2分) 1.40gX100g·mo□ 146g·mo1.50mlx0.97g·ml×100% (2分) (5)a.e(2分) 【解题思路】(2)①反应一段时间后,温度快速上升,说 明是放热反应。(3)①在酸性环境下,HSO;被 MnO,氧化成SO,MnO,被还原成Mn2+。②根 据题干信息中“环己醇过量”,副反应中的条件为加 热,可得产品偏黄的两个条件。 (4)根据环己醇与己二酸的关系式计算。 COOH -OH HOOC 100 146 1.5 mLX0.97 g-m m(己二酸)元论 m(己二酸)m伦一146g”mol厂×L.50mL× 0.97g·mL1÷100g·mol 实际产量 己二酸的产率一 理论产量 ×100%= 1.40g 146g·moX1.50mLx0,97g·mlLX100%. 100g·mol (5)KOOC(CH),COOK中存在的化学键有K与 一CO0之间的离子键,一C一C一之间的非极性键, 氢键是分子间作用力不是化学键,该物质中不存在金
样本阅读结束,请到下载地址中:阅读全文及下载