化学试卷-福建省部分地市校2025届高中毕业班3月质量检测
免费说明:开放式免费下载
高中、高三、2025年化学试卷、福建省部分地市校高中毕业班3月质量检测,教育小助手通过百度云盘、腾讯云盘分享Word版资源文件:化学试卷-福建省部分地市校2025届高中毕业班3月质量检测,若想获取Word版资源,请点立即下载!更多试题详解、参考答案、解析应有尽有,并且有海量历来真题,家长想要孩子提优就来下载打印刷真题吧

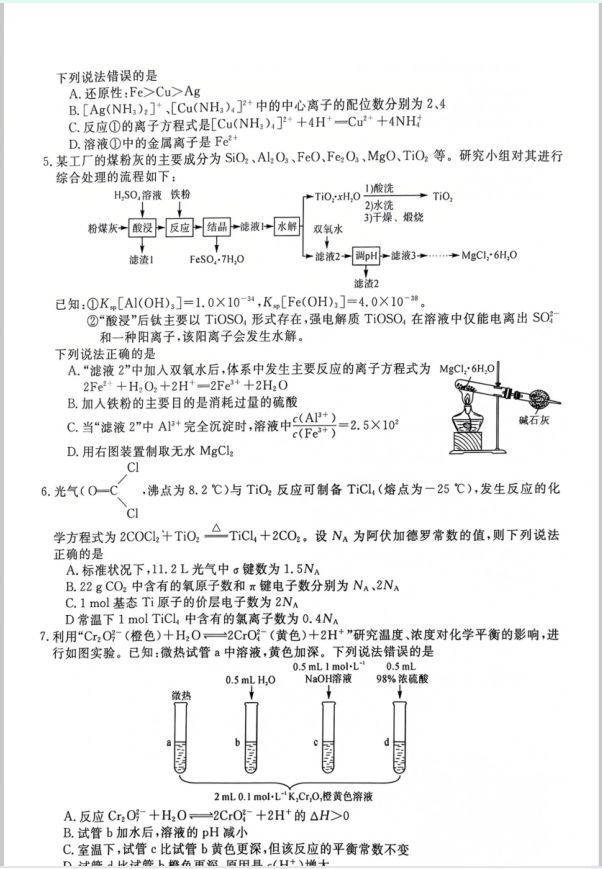
【解析海水淡化的方法主费有蒸璃法,反参透法和电渗新法等,A正确;电解每水不能得到金属镁,电解溶牌 的氯化镁可得到金属镁,B正确:深海海底的“可燃冰”是天然气水合物,属于不可再生能源,C正确:先将海 水蒸发转变为粗盐,发生的变化是物理变化,再将粗盐中的杂质离子C+、Mg+,SO等除去时,发生了化 学变化,D错误。 【答案C 【解析】该反应为加成反应,X含有硅键、醛基2种含氧官能团,A错误:Y分子中只有碳氧双键上的碳原子是 s即杂化,其余碳原子都是$p杂化,B错误:Z分子含有3个手性碳原子,图中虚线框内,含有苯环和猴基 2个平面,单键可以旋转,故所有碳原子可能共平面,C正确:X和Z都不含有酚羟基,不能用氯化铁溶液鉴 别:X含有醛基,Z不含有醛基,X和Z可以用银氨溶液鉴别,D错误。 【答案】B 【解析】根据题意和该除草剂的分子结构图可知,元素X、Y,Z.W,E分别为H.C、N,O,P。同周期主族元素 的第一电离能从左到右呈增大的趋势,但Z(N)的2p能级有3个电子,处于半充满,较稳定,故Z(N)的第一 电离能大于W(O》的第一电离能,第一电离能:C<O<N,即Y<W<Z:同周期主族元素从左到右元素的电 负性增强,氢元素的电负性在三者中最小,所以电负性:H<C<O,即X<Y<W,A正确:NH,分子间存在氢 键,故沸点NH高于PH,HO在常温下呈液态,NH在常温下呈气态,故简单氢化物沸点:PH<NH< HO,即E<Z<W,B错误;原子半径:O<N<C,原子半径越小,键长越短,则键长:H一O<H一N<H一C, C正确:NO的中心原子上的价层电子对数=2+5十1一2X2 =3,VSEPR模型为平面三角形,离子的空间 结构为V形,两者不相同,D正确。 【答案】D 【解析】金属活动性越强,金属的还原性越强,而且由题中的实验方案能得到证明,还原性由强到弱的顺序为 Fe>Cu>Ag,A正确;Ag(NH,):]中、[Cu(NH):门+中的中心离子的配位数分别为2、4,B正确:反应①中, 氯化四氨合铜溶液与浓盐酸反应生成氯化铜和氯化铵,该反应的离子方程式是[Cu(NH):]++4H+ Cu+十4NH时,C正确:向氯化铜和氯化铵的混合液中加入单质铁,铁置换出铜后生成F©+,然后Fc+被通 入的氧气氧化为Fe+,因此,溶液①中的金属离子是Fe3+,D错误。 【答案】A 【解析】煤粉灰的主要成分为SiO,,AlO、FcO、FeO,、MgO,TiO,等,酸浸后AlO、FcO、FeO、MgO分别 转化为A+,Fe2+,Fe+,Mg+,TiO2转化为TiOS),,强电解质TiOSO在溶液中仅能电离出SO和一种 阳离子,该阳离子会发生水解,即该阳离子为TO+,SiO2不反应,进人滤渣1中。加人铁粉,F®+被还原为 Fe2+,结品得到FeSO,·7HO,TiO+水解后得到TiO·xH:O,经过酸洗,水洗.干燥,煅烧,得到TiO2。滤 液2中加入双氧水,将Fe+氧化为Fe+,调节pH,可生成AI(OH)3、Fe(OH),沉淀。滤液3含有Mg+,经 过一系列操作,最后结品得到MgC1g·6H,O.由上述分析可知,“滤液2”中加人双氧水后,将F+氧化为 Fe+,体系中发生主要反应的离子方程式为2Fe2+十HO2十2H+一2Fe+十2H:O,A正确:加人铁粉的主要 目的是将Fe+还原为Fe2+,以便结品得到FeSO,·7H:O,B错误;当“滤液2”中A+完全沉淀时,Fe+早已 完全沉淀,溶液中A=A)·产(OH)-K[AI(OHD]=1.0X10 c(Fe)c(Fe )(OH-)Kp[Fe(OH)]4.0X10-35 =2,5×10,C错误:由于 Mg+能发生水解,为了抑制其水解,需要在氯化氢气流中加热MgC2·6H:O品体,方可制取无水MgC:· D错误【解析】标准状况下,光气不是气体,不能用22.4L·o计算其物质的量,A错误:C02的结构式为 O一C一0,1个CO2分子中含有2个氧原子和1个三中心4电子大π键,22g(即0.5mol)C0):中含有的氧 原子数为N,含有的大π键电子数为2NA,B正确:基态Ti原子的价层电子排布式为3d4s2,1mol基态Ti 原子的价层电子数为4N,C错误;TC,的熔点较低,是由分子构成的共价化合物,不含有离子,D错误。 【答案】B 【解析】微热试管a中溶液,黄色加深,说明升高温度,平衡正向移动,则该反应为吸热反应,即△H>0,A正 确:试管b加水后,平衡正向移动,(H+)增大,但c(H)减小,溶液的pH增大,B错误;试管c比试管b黄色 更深,平衡正向移动,但平衡常数只受温度的影响,平衡常数不变,C正确:试管d中加浓疏酸,溶液中c(H+) 增大,平衡逆向移动,溶液橙色变深,D正确。 【答案】D 【解析】由图可知,温度不同,反应历程不同,A正确:催化剂能降低脱硝反应的活化能,提高脱硝反应速率,但 催化剂不能使化学平衡发生移动,即不能提高N0的平衡转化率,B正确:脱硝反应分为两步:2NO十O2一 NO,6NO,+8NH,一7N,+12H:O,脱硝总反应的化学方程式为6NO+3O,+8NH_7N:+ 12HO,C正确:水分子和氨分子的中心原子都是sp杂化,由于氧原子,氨原子均有孤电子对,对共价键有 挤压作用,氨分子中的氨原子有1个孤电子对,水分子中的氧原子有2个孤电子对,孤电子对数目越多,挤压 作用越大,故键角:H2ONH,D错误 【答案】C 【解析】NRH:在a极上转化为NR,有机物失氢,发生氧化反应,则a极为阳极,a极应连接蓄电池的正极 PbO极,A错误:电解时,b极为阴极,NR在b极上发生还原反应,b极的电极反应为NR十2e+2H:O一 NRH2十2OH,B错误;因为a极的电极反应需要HCO,所以左储液罐溶液中发生反应的离子方程式为 CO+OH-一HCO方,C正确:根据左储液罐溶液中发生反应的离子方程式CO+OH一HCO和b极的 电极反应式NR十2e十2HzO一NRH2十2OH,列出关系式:CO2一OH一e,可知理论上每捕获空气中 的1 mol CO,电路中转移1mol电子,D错误。 【答案】C 【解析】随着溶液的pH增大,c(H)减小,乙酸电离平衡CH COOH一CH,CO)厂十H正向移动, c(CH COOH)减小,(CH COO)增大,即CH,COOH的摩尔分数或小,CH,COO的摩尔分数增大,同时 Ag(aq)+CH,COO(aq)一CH,COOAg(aq)的平衡正向移动,CH,COOAg的摩尔分数也增大,但当pH 增大到一定程度时,部分Ag转化为AgOH沉淀,使得平衡Ag(ag)十CH,COO(aq)CH COOAg(ag)逆向 移动,CH,COOAg的摩尔分数成小,CH COO的摩尔分数增大,故曲线I代表CH,COOH的摩尔分数与 pH的变化关系,曲线Ⅱ代表CH.COO的摩尔分数与pH的变化关系,曲线Ⅲ代表CH,COOAg的摩尔分 数与pH的变化关系,A正确:由图可知,当c(CH COOH)=c(CHCO))时(即曲线I和曲线I的交点),溶液的pH (2)2NH,CI+Ca(OH),≌CaCL,+2NH◆+2H,O(2分) (3)氨气极易溶于水,若用长导管替换长颈漏斗,会发生倒吸(2分) (4)先生成蓝色沉淀,后蓝色沉淀逐渐溶解,溶液变为深蓝色(2分) (5)降低溶剂的极性,有利于[Cu(NH),SO4·H2O结品析出(2分) (6)滴入最后半滴NOH溶液,溶液颜色从无色刚好变为粉红色,且半分钟内不变色(2分) (7)2.5(Y-V,)X10X246(或其他正确答案)(2分) (8)abd(2分。少选且正确的,给1分:选错或多选的,不给分) 【解析】(7)根据关系式[Cu(NH,)4]SO)·HO4NH一4HCI和HC一NOH可知,产品中[Cu(NH)]S)·HO 子(W,-V2)X10×246 的纯度= 2×100%=2.5(Y-V,)X10X245×100%. (8)未将产生的氮全部蒸出,导致剩余的盐酸偏多,则消耗NaOH溶液的体积V:偏大,故导致所测 [Cu(NH,),]SO,·H2O纯度偏低,a符合题意;未使用0,1000mol·L NaOH溶液润洗滴定管,导致滴 定管中的NaOH溶液的浓度偏低,则消耗NaOH溶液的体积V:偏大,故导致所测[Cu(NH),]SO,·HzO 纯度偏低,b符合题意:终点时滴定管尖嘴内有气泡,导致V2偏小,故导致所测[Cu(NH):]SO·HO纯 度偏高,c不符合题意:终点读数时仰视滴定管刻度线,导致读数V偏大,故导致所测[Cu(NH),]S)·HO纯 度偏低,d符合题意。 【答案及评分细则】(15分) (1)氨基.酯基(2分) (2)消去反应(2分》平面三角形(2分)
样本阅读结束,请到下载地址中:阅读全文及下载