东北三省(辽宁,吉林,黑龙江)精准教学联盟2024-2025学年高三下学期3月联考,高中\高三\多省联考\2024-2025学年下\化学三零论坛(30论坛)用百度云盘、腾讯云盘分享的原卷版、解析版及答案,在云盘中的课件资料可在线阅读及保存到自己的云盘,此电子版课件永久免费阅读及下载。

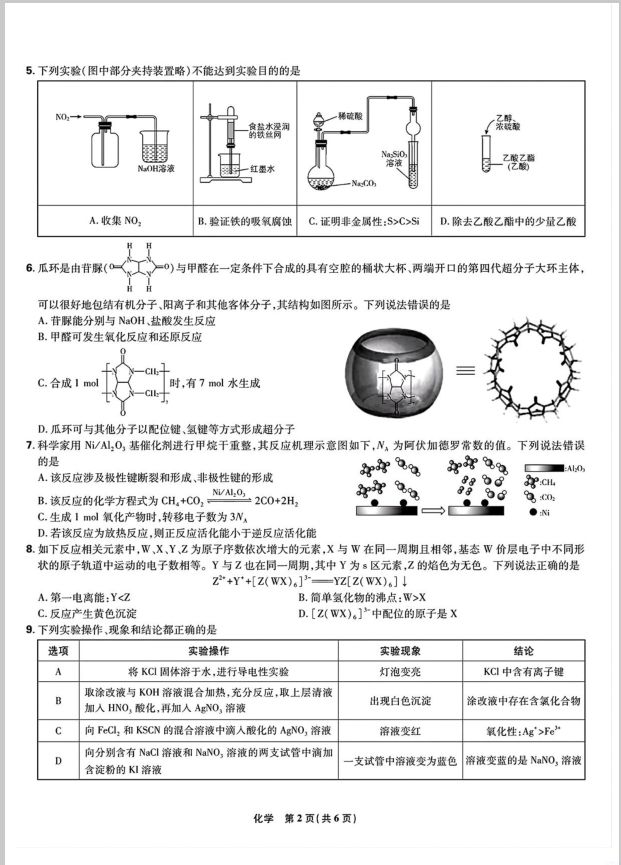
5.下列实验(图中部分夹持装置略)不能达到实验目的的是 NO 稀硫酸 食盐水漫润 的铁丝同 Z酸乙 OH溶液 红墨水 (乙酸 A.收集NO B.验证铁的吸氧腐蚀 C.证明非金属性:S>C>S D.除去乙酸乙酯中的少量乙酸 H 6.瓜环是由背脲(0 0)与甲醛在一定条件下合成的具有空腔的桶状大杯、两端开口的第四代超分子大环主体, 可以很好地包结有机分子、阳离子和其他客体分子,其结构如图所示。下列说法错误的是 A.苷脲能分别与NaOH、盐酸发生反应 B.甲醛可发生氧化反应和还原反应 C.合成mol 时,有7mol水生成 D.瓜环可与其他分子以配位键、氢键等方式形成超分子 7.科学家用N/,0,基催化剂进行甲烷干重整,其反应机理示意图如下,N。为阿伏加德罗常数的值。下列说法错误 的是 :Al A.该反应涉及极性键断裂和形成、非极性键的形成 .ci B.该反应的化学方程式为CH+C0, Nw:02C0+2H, 。00 C.生成1mol氧化产物时.转移电子数为3N, ● D,若该反应为放热反应,侧正反应活化能小于逆反应活化能 8.如下反应相关元素中,W,X、Y、Z为原子序数依次增大的元素,X与W在同一周期且相邻,基态W价层电子中不同形 状的原子轨道中运动的电子数相等。Y与Z也在同一周期,其中Y为s区元素,Z的焰色为无色。下列说法正确的是 Z*+Y'+[Z(WX).]-YZ[Z(WX).] A.第一电离能:Y<Z B.简单氢化物的沸点:W>X C.反应产生黄色沉淀 D.[Z(WX)。]>中配位的原子是X 9.下列实验操作,现象和结论都正确的是 选项 实验操作 实验现象 结论 将KC固体溶于水,进行导电性实验 灯泡变亮 KCI中含有离子键 取涂改液与KO州溶液混合加热,充分反应,取上层清液 B 出现白色沉淀 涂改液中存在含氣化合物 加人HNO,酸化,再加人AgNO,溶液 C 向FCl:和KSCN的混合溶液中滴人酸化的AgNO,溶液 溶液变红 氧化性:Ag'>Fe” 向分别含有NaC1溶液和NaNO,溶液的两支试管中滴加 D 支试管中溶液变为蓝色 溶液变蓝的是NaNO,溶液 含淀粉的KI溶液 10.类比思想是化学学习中的重要思想。下列各项中由客观事实类比得到的结论正确的是 A.Fe,Cl,根据化合价规律可表示为FcCl:·2FcCl,则Fe,l,也可以表示为Fel2·2Fcl B.Cl可使紫色石蔑溶液先变红后褪色,则S0:也可使紫色石鬻溶液先变红后褪色 C,HC在一定条件下能被MnO氧化为Cl2,则HBr在一定条件下也能被MnO3氧化为Br D.少量C0,通入NaC0溶液中生成NaHC0,则少量C0,通人Ca(C0),溶液中生成Ca(HC0,): 11.某温度下,在恒容密闭容器中充人一定量的X(g),发生下列反应: 反应I.X(g)一Y(s)△H,<0,反应Ⅱ.Y(g)一Z(g)△H2<0 两个反应的平衡常数分别为K,、K:,测得各气体浓度与反应时间的关系如图所示。下列说 法错误的是 A.X的初始浓度为1.5mal·L B.体系内压强不再变化,则反应达到平衡 C.0-5s内,X的平均反应速率(X)=0.24m0·L·s D.升高温度,反应I、Ⅱ的速率均增大,K,,K,均减小 12.α,B-不饱和铜是许多药物中间体的重要组成部分。科学家们用 电 苯甲醇和丙闲电催化氧化法制备《,B-不饱和酮 的工 CHOH 作原理如图所示。下列说法错误的是 A.M极电势高于N极 B.反应一段时间后阳极区电解质溶液pH减小 0 C,生成1mol 时,电路中转移4ol电子 H.O 01m+L- n.1ml·4N减OH溶液 NaO1I客液 D.当用苯甲醇与2-丁酮(儿)电催化氧化可得个 阴离子文换暖 13.某工厂利用a1氧化锌废渣(含C0和P0)制备出b1锌,其流程如下。 已知Me0+2NH,Cl一Me(NH),Cl2+H0(Me为Zn、Ca,Pb),下 NH口溶滚 7粉 列说法错误的是 氧化销 度洁 浸出 曾株 电解 +锌 A.1mol[Zn(NH,):]2”中含有8molg键 at 61 B.“置换”中Cu元素发生的反应:Cu(NH,),Cl+Za 固体 Zn(NH,)Cl,+Cu C.“电解"时阳极总反应为[2n(NH,):]-6e一N,↑+Za+6H D.氧化锌废流中锌的质量分数为。×100% 14.混合卤化物有理想的光电性能,可用于高效太阳能电池。其两种品胞结构如图所示。已知品胞a中M原子的分数坐 标为(0,0,0)。下列说法错误的是 A.晶胞a中距I最近的Pb有4个 0 B.品胞b的俯视图为 品韵 C品胞a中N原子的分数坐标为(子0,宁) D.晶胞a和b的混合岗化物的化学式均为CsPbI:Br 15.常温下,向浓度相等的甲酸(HCOOH)和醋酸(HAe)的混合溶液中滴加氨水(已知:甲酸酸性强于醋酸), 溶液中pX[pX=-gX,X=cHC00) c(Ac) e(NH) c(HCOOH)'c(HAc)c(NH,HO) 与H的关系如图所示。下列叙述错误的是 A代表XC09与H的变化关界 B.常温下,K(HAC)=I04w C.向L2代表的酸中滴加氨水至Q点:pH<7 D.向上述混合溶液中滴加氨水至恰好完全反应时:c(NH)= c(Ae)+c(HC00°) 4.24 8.759.76 二、非选择题:本题共4小题,共55分。 16.(14分)四碘化锡(Sl,)是一种橙色针状品体,遇水易水解,常用作分析试剂和有机合成试 剂。某实验小组用金属锡(S)和碘(L)在非水溶剂中合成Sl,并测定产物纯度。实验操 作如下: I,称取0.5g碎锡片和2.2g碘置于洁净干燥的圆底烧瓶中。 Ⅱ.向圆底烧瓶中加人25mL无水乙酸和25mL乙酸酐(H,C0CH,),再加入少量沸石,防 止暴沸。 Ⅲ.按图组装好冷凝管和干燥管,点燃加热装置,使混合物沸腾并保持回流1~1.5h,待反应 完全,停止加热,冷却混合物,抽滤分离。 V.将制得的SL,品体放在小烧杯中,加人20mL氯仿,温水浴溶解,过滤,除去杂质。 V,在通风橱中将滤液蒸发结品,得到橙红色品体2.2g,色谱检测纯度为98.0%。 (1)实验中,所有仪器必须干燥的目的是 实验小组同学加热过程中发现未加沸石,应立 即停止加热,并 (2)当圆底烧瓶中 时,可知反应已进行完全。 (3)下列仪器中,步骤V和V提纯过程中都不需使用的是 (填名称)。 (4)将制得的四碘化锡溶于水,发生反应的化学方程式为 (5)该实验中四碘化锡的产率为 (精确至0.1毫)。 (6)若使用质谱仪对乙酸和乙酸酐混合物进行检测,获取质谱图中最右侧分子离子峰的质荷比数值 为 17.(13分)以一种镍钴废料(主要成分为Co,0,.Co0、Ni0,含少量的Cu0.Mn01.Al0,.Fc0、Fe0,等)为原 料回收Co、Ni的工艺流程如下: 破酸NS.0 有机相 0法 NS 反萃取 CoCl-+Co 蝶钻度料+ 酸浸还源 氧化调H 沉铜 草取 纯碱 水相 湾渣2 沉锰 电解 湾清3 已知:I,焦亚硫酸钠(Na:S:0s)是一种常见的食品抗氧化剂。 Ⅱ,25℃时,部分金属阳离子恰好完全形成氢氧化物沉淀时的H:
样本阅读结束,请到下载地址中:阅读全文及下载